

最初の展示に足を踏み入れる
PsAの病理生物学を探る
PsA=乾癬性関節炎。
PsAの慢性炎症性病因は複雑かつ多因子である。…
…複数の獲得免疫 と 自然免疫細胞と炎症誘発性サイトカインが関与している。1


Iain McInnes教授の講義シリーズ
PsAにおけるサイトカインとその役割の新しい発見を知る
分子医学の進歩がPsAの病態理解にどのような変革をもたらしたか、著名なリウマチ学の研究者であり、臨床医でもあるIain McInnes教授の講義をみてみましょう。
PsAに至る病態
PsAに至る病態はまだ完全には解明されていない。しかし、最近の研究では、さまざまな臨床症状・徴候に関連する慢性炎症の開始と維持には、サイトカイン経路と細胞の複雑な相互作用が関与していることが明らかになっている。1-4 PsAの病態は、臨床症状・徴候によって異なることが多い。1,2
炎症を引き起こすサイトカインの役割
最新のエビデンスによると、TNF、IL-17A、IL-17F、IL-12、IL-23などのサイトカインや、JAK/STAT経路、PDE4が直接的あるいは間接的に関与するサイトカインが、SpAのさまざまな組織で炎症を引き起こす上で、それぞれ異なる役割を担っている。それぞれの相対的な寄与は複雑であるが、どのサイトカインがさまざまな臨床症状・徴候やSpAの疾患表現型に寄与しているのかについて、重要な区別が生まれつつある。4,5,6,7-9
JAK=ヤヌスキナーゼ


IL-17ファミリー
IL-17サイトカインファミリーは、IL-17A、IL-17B、IL-17C、IL-17D、IL-17EおよびIL-17Fを含む6つのメンバーから構成されている。10,14
IL-17AとIL-17Fは50%以下の構造的相同性を共有し、同様の炎症誘発機能を持ち、同じ受容体複合体を介してシグナルを伝達する。13 IL-17AとIL-17Fはホモ二量体およびヘテロ二量体として存在する。つまり、3つのサイトカイン(IL-17A/A、IL-7A/FおよびIL-17F/F)が存在することが研究で示されており、これらすべてはPsAの炎症に寄与することが示されている。13,15
IL-17受容体ファミリーには5つのメンバーがある。2つのIL-17受容体(IL-17RCとIL-17RA)が協調してIL-17A/A、IL-17F/F、IL-17A/Fによるシグナル伝達を媒介すると考えられている。12,14
IL-17AとIL-17Fは、TNFのような他の炎症メディエータと協力して、炎症反応を増幅することが研究で示されている。13 病的な骨形成に対するIL-17AとIL-17Fの寄与は、骨形成分化のモデルで示されており、骨病変におけるIL-17AとIL-17Fの重要性を示している。11
PsAでは、皮膚病変と炎症を起こした滑膜は、IL-17AとIL-17Fの発現と亢進で類似のパターンを示し、IL-17AはIL-17Fよりも強力であるが、IL-17Fのタンパク質レベルはIL-17Aのそれよりも~30倍高い。16


Iain McInnes教授の講義シリーズ
PsAの病態におけるIL-23-IL-17軸の役割についてより深く理解する
さまざまな組織におけるIL-23-IL-17軸サイトカインの役割について、Iain McInnes教授が最新の科学的知見に迫ります。
エビデンスによるとIL-17はIL-23依存経路とIL-23非依存経路の両方によって制御されていることを示されている
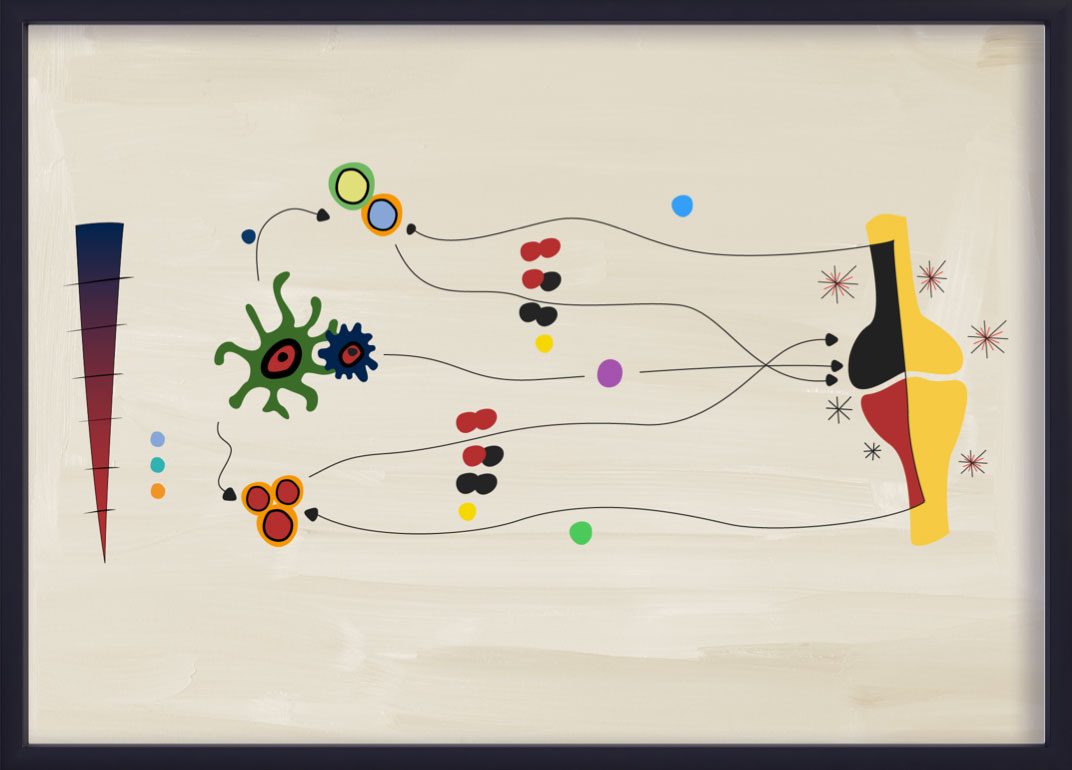
IL-23–IL-17軸のプロセス
IL-23は、Th17細胞からのIL-17AとIL-17Fの産生を含むTh17サブセットの増殖と生存を促進する役割を担っている。このプロセスは一般にIL-23-IL-17軸と呼ばれ、PsAを含むいくつかの炎症性疾患に関与している。14,15,20,21
最近のエビデンスでは、IL-23–IL-17軸は、PsAにおける直線的な「カスケード」ではないことが示唆されている。22IL-23とIL-17は、部分的に重複しているが、異なる生物学と病理生物学を示している。22IL-23–IL-17獲得免疫経路は、いまだにPsAにおける炎症の主要な促進因子であると考えられているが、自然免疫系の細胞もIL-23とは独立してIL-17AとIL-17Fを産生することができる。20,22PsAにおける獲得免疫細胞シグナル伝達経路は、IL-23によって大きく促進されている。21,23


IL-23
IL-23はPsAにおけるIL-17の重要な上流制御因子である14,22。
IL-23 はIL-12スーパーファミリーのメンバーであり、p40鎖とp19鎖からなるヘテロ二量体である。14,21乾癬、PsA、axSpA、IBDを含むいくつかの免疫介在性炎症性疾患の発症に関与する重要なサイトカインである。21しかしながら、異なる細胞や下流のサイトカイン経路との相互作用は、疾患によって異なる可能性がある。21
IL-23は腸管や皮膚などの{/t2}{t3}樹状{/t3}{t4}細胞が活性化されたバリア部位からPsAの疾患発症部位に移動することを示すいくつかの証拠があるが、さらに研究をする必要がある。21
IL-23の重要な炎症誘発作用は、IL-17、IL-22、TNFを産生するためのTh17細胞の刺激であり、その結果、下流の炎症、骨形成、骨びらんを引き起こす。6,14,21 しかし、最近の証拠によると、IL-23はPsAのシグナル伝達にも直接関与している可能性がある。21,23病原性シグナル伝達の促進におけるIL-23への依存性は、異なる炎症性疾患間で異なっているようであり、直接的なIL-23シグナル伝達はaxSpAと比較してPsA においてより顕著な役割を担っているのかもしれない。21,23これはサイトカインの発現部位の違いに関連している可能性がある。例えば、IL-23–IL-17軸に関連するサイトカインの発現は、皮膚の病変部位で連続的に発現していることが示されているが、関節での発現にはばらつきがある。6,21,23
IL-23は、IL-17依存的あるいはIL-17非依存的なメカニズムのいずれかを介して多くの標的細胞に作用し、どちらも炎症組織内の炎症細胞のリクルートをもたらす。23
- IL-17依存性経路:IL-23はIL-23Rを介してTh17細胞を刺激し、IL-17やIL-22などの分子の放出を誘導する。 IL-17RまたはIL-22Rが同族受容体と結合することによって、最終的に「エフェクター細胞」であるケラチノサイト、B細胞、破骨細胞前駆体、マクロファージ、線維芽細胞様の滑膜細胞が活性化される。23
- IL-17非依存性経路:標的細胞の同じサブセットは、IL-23Rを介して、IL-17非依存的にIL-23によって直接投与することができる。23
IBD=炎症性腸疾患。
IL-23を阻害する生物学的製剤の臨床試験では優位性を見いだせなかったため、axSpAの病理生物学におけるこのサイトカインの役割は不明。


IL-12
PsAにおけるIL-12の役割
IL-12は2つのサブユニット(p35とp40)からなる炎症誘発性サイトカインで、活性型ヘテロ二量体p70を形成する。26自然免疫細胞によって産生され、未分化のT細胞をIFN-γを産生するTh1細胞への分化を誘導し、T細胞の疲弊を防ぐ。26,27
IL-12とIL-23の活性は密接に関連している。これらの炎症性サイトカインはどちらもp40サブユニットと受容体鎖(IL-12R1)を共有しており、それぞれ異なるIL-12とIL-23のシグナル伝達経路を制御している26
PsAでは、IL-12とIL-23の過剰活性化により、循環しているTh1とTh17細胞の数が増加する。これにより、サイトカインやタンパク質からのシグナル伝達が活性化され、乾癬の丘疹の発生につながる。28,29PsAへの感受性は、IL-23RのリガンドサブユニットをコードするIL-12b遺伝子の一塩基多型と関連している。26


TNF
TNFシグナルはPsAの病態に関与している
TNFスーパーファミリー(TNFSF)は、構造的に関連する19種類の多面作用性サイトカインから構成されている。31,32TNFSFタンパク質は炎症の主要な促進因子であり、アポトーシス、血管形成、細胞増殖、その他の重要な生物学的機能の調節に関与している。31
TNF-α膜貫通型と可溶性型があり、主にT細胞、NK細胞、マクロファージによって作られる。33細胞内シグナル伝達は2つの受容体TNF-受容体1(TNFR1)とTNFR2を通して起こるが、これらは細胞内シグナル伝達のメカニズム、リガンド親和性、発現パターンが異なっている。34,35TNFR1は炎症性免疫反応と自然免疫反応に関与する支配的な受容体である。36
TNFの過剰発現は、Th1およびTh17細胞によって媒介されると考えられている病原性の炎症誘発性状態を促進する。32TNFの上昇レベルは、滑膜や皮膚症状・徴候で知られる他の部位、および付着部、関節、脊椎の病変で認められる。30,37活性化された樹状細胞は、TNF-αやその他の炎症誘発性サイトカイン(例.IL-6、IL-12、IL-23など)を分泌し、T細胞シグナル伝達の増加とTh細胞の分化をもたらす。32Th1およびTh17細胞は、破骨細胞の産生、骨/軟骨のびらん、および異常な骨形成をもたらす、滑液の炎症誘発性サイトカインの産生を亢進する。38
PsAでは、TNFはIL-17およびIL-23経路と相乗的に作用する
- IL-23はTh17細胞の分化を刺激し、IL-17などのサイトカインの産生を引き起こし、TNFのさらなる亢進を引き起こす。35
- IL-17はTNFと結合し、どのサイトカインが単独で作用するよりも強い炎症誘発性サイトカインの発現を引き起こす。39


JAK-STAT
JAK-STAT経路はPsAの発症に重要な役割を果たしている可能性がある
JAK分子は細胞内チロシンキナーゼの一群で、4つのアイソフォームからなる:JAK1、JAK2、JAK3、およびTYK2。41これらのグループは、シグナル転写因子および転写活性化因子(STAT)分子と結合している。9多くの免疫細胞とエフェクター分子は、JAK分子とSTAT分子の異なる組み合わせを用いて、細胞表面から核へのシグナルを変換し、そこで転写を活性化し、遺伝子の活性化を誘導する。この下流の遺伝子の活性化は、PsAにおける病態の活性化を含む、さまざまな生物学的プロセスを制御する役割を担っている。9,40,42多くのSpA関連サイトカインは、直接的または間接的にJAK-STAT経路を媒介する。40
JAK=ヤヌスキナーゼ;TYK=チロシンキナーゼ。
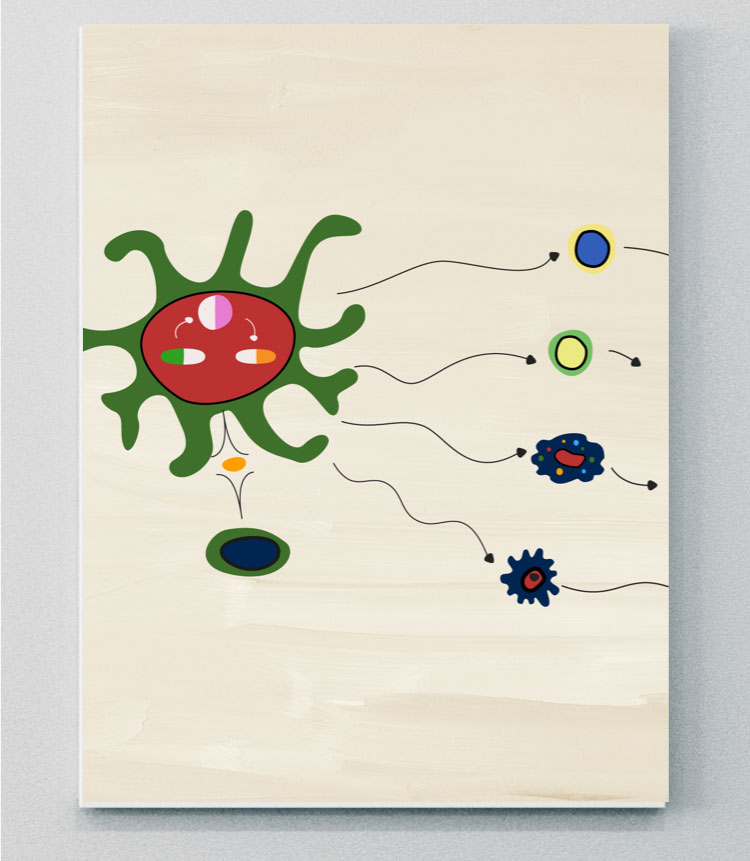

PDE4
PsAを引き起こす炎症反応の細胞メディエータ
PDE4はホスホジエステラーゼ酵素ファミリーの一員であり、cAMPやcGMPを含む細胞内セカンドメッセンジャーの分解を触媒し、さまざまな炎症メカニズムに関与している。4
PsAではcAMPの調節が阻害されており、これはcAMPからAMPへの加水分解を触媒するPDE4の増加によって引き起こされると考えられている。4,43AMPレベルの増加は、炎症性サイトカインの不均衡(すなわち、TNF、IL-17、IFN、IL-23の炎症性サイトカイン発現の増加、IL-10のような制御性サイトカインの減少)を引き起こし、病的骨形成と骨びらんにつながる炎症経路を促進する。4,44
PDE=ホスホジエステラーゼ。
科学アニメーションシアターを見る
PsAを引き起こすメカニズムを解明する

数種類のサイトカインが、axSpAにおける炎症の促進において、それぞれ異なる役割を担っていることを発見する


PsAに関する次の展示室
免疫調節異常
サイトカイン調節異常がPsAにおける炎症を引き起こす仕組みを探る。
axSpAおよびPsAに関する詳しい情報については、UCBCares® Rheumatologyに登録してください
- Veale DJ, Fearon U. The pathogenesis of psoriatic arthritis. Lancet. 2018;391(10136):2273-2284. doi:10.1016/S0140-6736(18)30830-4
- Bravo A, Kavanaugh A. Bedside to bench: defining the immunopathogenesis of psoriatic arthritis. Nat Rev Rheumatol. 2019;15(11):645-656. doi:10.1038/s41584-019-0285-8
- Crispino N, Ciccia F. JAK/STAT pathway and nociceptive cytokine signaling in rheumatoid arthritis and psoriatic arthritis. Clin Exp Rheumatol. 2021;39(3):668-675
- Picchianti-Diamanti A, Spinelli FR, Rosado MM, et al. Inhibition of phosphodiesterase-4 in psoriatic arthritis and inflammatory bowel diseases. Int J Mol Sci. 2021;22(5):2638. Published 2021 Mar 5. doi:10.3390/ijms22052638
- Rezaiemanesh A, Abdolmaleki M, Abdolmohammadi K, et al. Immune cells involved in the pathogenesis of ankylosing spondylitis. Biomed Pharmacother. 2018;100:198-204. doi:10.1016/j.biopha.2018.01.108
- McGonagle DG, McInnes IB, Kirkham BW, et al. The role of IL-17A in axial spondyloarthritis and psoriatic arthritis: recent advances and controversies [公開された修正がAnn Rheum Dis. 2020;79(1):e12に掲載]. Ann Rheum Dis. 2019;78(9):1167-1178. doi:10.1136/annrheumdis-2019-215356
- Siebert S, Millar NL, McInnes IB. Why did IL-23p19 inhibition fail in AS: a tale of tissues, trials or translation?. Ann Rheum Dis. 2019;78(8):1015-1018. doi:10.1136/annrheumdis-2018-213654
- Rosine N, Miceli-Richard C. Innate cells: the alternative source of IL-17 in axial and peripheral spondyloarthritis?. Front Immunol. 2021;11:553742. Published 2021. doi:10.3389/fimmu.2020.553742
- Hammitzsch A, Lorenz G, Moog P. Impact of janus kinase inhibition on the treatment of axial spondyloarthropathies. Front Immunol. 2020;11:591176. Published 2020. doi:10.3389/fimmu.2020.591176
- Yang XO, Chang SH, Park H, et al. Regulation of inflammatory responses by IL-17F. J Exp Med. 2008;205(5):1063-1075. doi:10.1084/jem.20071978
- Shah M, Maroof A, Gikas P, et al. Dual neutralisation of IL-17F and IL-17A with bimekizumab blocks inflammation-driven osteogenic differentiation of human periosteal cells. RMD Open. 2020;6(2):e001306. doi:10.1136/rmdopen-2020-001306
- Goepfert A, Lehmann S, Blank J, et al. Structural Analysis Reveals that the Cytokine IL-17F Forms a Homodimeric Complex with Receptor IL-17RC to Drive IL-17RA-Independent Signaling. Immunity. 2020;52(3):499-512.e5. doi:10.1016/j.immuni.2020.02.004
- Glatt S, Baeten D, Baker T, et al. Dual IL-17A and IL-17F neutralisation by bimekizumab in psoriatic arthritis: evidence from preclinical experiments and a randomised placebo-controlled clinical trial that IL-17F contributes to human chronic tissue inflammation. Ann Rheum Dis. 2018;77(4):523-532. doi:10.1136/annrheumdis-2017-212127
- Tsukazaki H, Kaito T. The role of the IL-23/IL-17 pathway in the pathogenesis of spondyloarthritis. Int J Mol Sci. 2020;21(17):6401. Published 2020. doi:10.3390/ijms21176401
- Bridgewood C, Sharif K, Sherlock J, et al. Interleukin-23 pathway at the enthesis: The emerging story of enthesitis in spondyloarthropathy. Immunol Rev. 2020;294(1):27-47. doi:10.1111/imr.12840
- Ritchlin CT, Kavanaugh A, Merola JF, et al. Bimekizumab in patients with active psoriatic arthritis: results from a 48-week, randomised, double-blind, placebo-controlled, dose-ranging phase 2b trial. Lancet. 2020;395(10222):427-440. doi:10.1016/S0140-6736(19)33161-7
- Blanco P, Palucka AK, Pascual V, et al. Dendritic cells and cytokines in human inflammatory and autoimmune diseases. Cytokine Growth Factor Rev. 2008;19(1):41-52. doi:10.1016/j.cytogfr.2007.10.004
- Cole S, Murray J, Simpson C, et al. Interleukin (IL)-12 and IL-18 synergize to promote MAIT cell IL-17A and IL-17F production independently of IL-23 signaling. Front Immunol. 2020;11:585134. Published 2020. doi:10.3389/fimmu.2020.585134
- Russell T, Watad A, Bridgewood C, et al. IL-17A and TNF modulate normal human spinal entheseal bone and soft tissue mesenchymal stem cell osteogenesis, adipogenesis, and stromal function. Cells. 2021;10(2):341. Published 2021. doi:10.3390/cells10020341
- McGonagle D, Watad A, Sharif K, et al. Why inhibition of IL-23 lacked efficacy in ankylosing spondylitis. Front Immunol. 2021;12:614255. Published 2021. doi:10.3389/fimmu.2021.614255
- Mease P, Van den Bosch F. IL-23 and axial disease: do they come together? Rheumatology. 2021;60(Suppl 4):iv28-iv33. doi:10.1093/rheumatology/keab617
- Baeten D, Adamopoulos IE. IL-23 inhibition in ankylosing spondylitis: where did it go wrong?. Front Immunol. 2021;11:623874. Published 2021. doi:10.3389/fimmu.2020.623874
- Boutet MA, Nerviani A, Gallo Afflitto G, et al. Role of the IL-23/IL-17 axis in psoriasis and psoriatic arthritis: the clinical importance of its divergence in skin and joints. Int J Mol Sci. 2018;19(2):530. Published 2018. doi:10.3390/ijms19020530
- Taams LS, Steel KJA, Srenathan U, et al. IL-17 in the immunopathogenesis of spondyloarthritis. Nat Rev Rheum. 2018;14(8):453–466. Published 2018. doi: 10.1038/s41584-018-0044-2
- Zhu W, He X, Cheng K, et al. Ankylosing spondylitis: etiology, pathogenesis, and treatments. Bone Res. 2019;7:22. Published 2019. doi:10.1038/s41413-019-0057-8
- Schurich A, Raine C, Morris V, et al. The role of IL-12/23 in T cell-related chronic inflammation: implications of immunodeficiency and therapeutic blockade. Rheumatology (Oxford). 2018;57(2):246-254. doi:10.1093/rheumatology/kex186
- Trinchieri G. Interleukin-12: a proinflammatory cytokine with immunoregulatory functions that bridge innate resistance and antigen-specific adaptive immunity. Annu Rev Immunol. 1995;13:251-276. doi:10.1146/annurev.iy.13.040195.001343
- Johnsson HJ, McInnes IB. Interleukin-12 and interleukin-23 inhibition in psoriatic arthritis. Clin Exp Rheumatol. 2015;33(5 Suppl 93):S115-S118
- Chyuan IT, Lai JH. New insights into the IL-12 and IL-23: From a molecular basis to clinical application in immune-mediated inflammation and cancers. Biochem Pharmacol. 2020;175:113928. doi:10.1016/j.bcp.2020.113928
- Silvagni E, Missiroli S, Perrone M, et al. From bed to bench and back: TNF-α, IL-23/IL-17A, and JAK-dependent inflammation in the pathogenesis of psoriatic synovitis. Front Pharmacol. 2021;12:672515. Published 2021. doi:10.3389/fphar.2021.672515
- Aggarwal BB, Gupta SC, Kim JH. Historical perspectives on tumor necrosis factor and its superfamily: 25 years later, a golden journey. Blood. 2012;119(3):651-665. doi:10.1182/blood-2011-04-325225
- Croft M, Siegel RM. Beyond TNF: TNF superfamily cytokines as targets for the treatment of rheumatic diseases. Nat Rev Rheumatol. 2017;13(4):217-233. doi:10.1038/nrrheum.2017.22
- Jang DI, Lee AH, Shin HY, et al. The role of tumor necrosis factor alpha (TNF-α) in autoimmune disease and current TNF-α inhibitors in therapeutics. Int J Mol Sci. 2021;22(5):2719. Published 2021. doi:10.3390/ijms22052719
- Holbrook J, Lara-Reyna S, Jarosz-Griffiths H, McDermott M. Tumour necrosis factor signaling in health and disease. F1000Res. 2019;8:F1000 Faculty Rev-111. Published 2019. doi:10.12688/f1000research.17023.1
- Mantravadi S, Ogdie A, Kraft WK. Tumor necrosis factor inhibitors in psoriatic arthritis. Expert Rev Clin Pharmacol. 2017;10(8):899-910. doi:10.1080/17512433.2017.1329009
- Lata M, Hettinghouse AS, Liu CJ. Targeting tumor necrosis factor receptors in ankylosing spondylitis. Ann N Y Acad Sci. 2019;1442(1):5-16. doi:10.1111/nyas.13933
- Addimanda O, Possemato N, Caruso A, et al. The role of tumor necrosis factor-α blockers in psoriatic disease. Therapeutic Options in Psoriatic Arthritis. J Rheumatol Suppl. 2015;93:73-78. doi:10.3899/jrheum.150642
- Liu J, Dong Z, Zhu Q, et al. TNF-α promoter polymorphisms predict the response to etanercept more powerfully than that to infliximab/adalimumab in spondyloarthritis. Sci Rep. 2016;6:32202. Published 2016. doi:10.1038/srep32202
- Noack M, Beringer A, Miossec P. Additive or synergistic interactions between IL-17A or IL-17F and TNF or IL-1β depend on the cell type. Front Immunol. 2019;10:1726. Published 2019. doi:10.3389/fimmu.2019.01726
- McInnes IB, Szekanecz Z, McGonagle D, et al. A review of JAK-STAT signaling in the pathogenesis of spondyloarthritis and the role of JAK inhibition [2021年オンライン版先行公開]。Rheumatology (Oxford). 2021;keab740. doi:10.1093/rheumatology/keab740
- White JPE, Coates LC. JAK1 selective inhibitors for the treatment of spondyloarthropathies. Rheumatology (Oxford). 2021;60(Suppl 2):ii39-ii44. doi:10.1093/rheumatology/keaa815
- Fragoulis GE, McInnes IB, Siebert S. JAK-inhibitors. New players in the field of immune-mediated diseases, beyond rheumatoid arthritis. Rheumatology (Oxford). 2019;58(Suppl 1):i43-i54. Published 2019. doi: 10.1093/rheumatology/key276.
- Kilanowska A, Ziółkowska A. Role of phosphodiesterase in the biology and pathology of diabetes. Int J Mol Sci. 2020;21(21):8244. Published 2020. doi:10.3390/ijms21218244
- Li H, Zuo J, Tang W. Phosphodiesterase-4 inhibitors for the treatment of inflammatory diseases. Front Pharmacol. 2018;9:1048. Published 2018. doi:10.3389/fphar.2018.01048