

免疫調節異常がPsAに
おける炎症を引き起こす
仕組みを探る
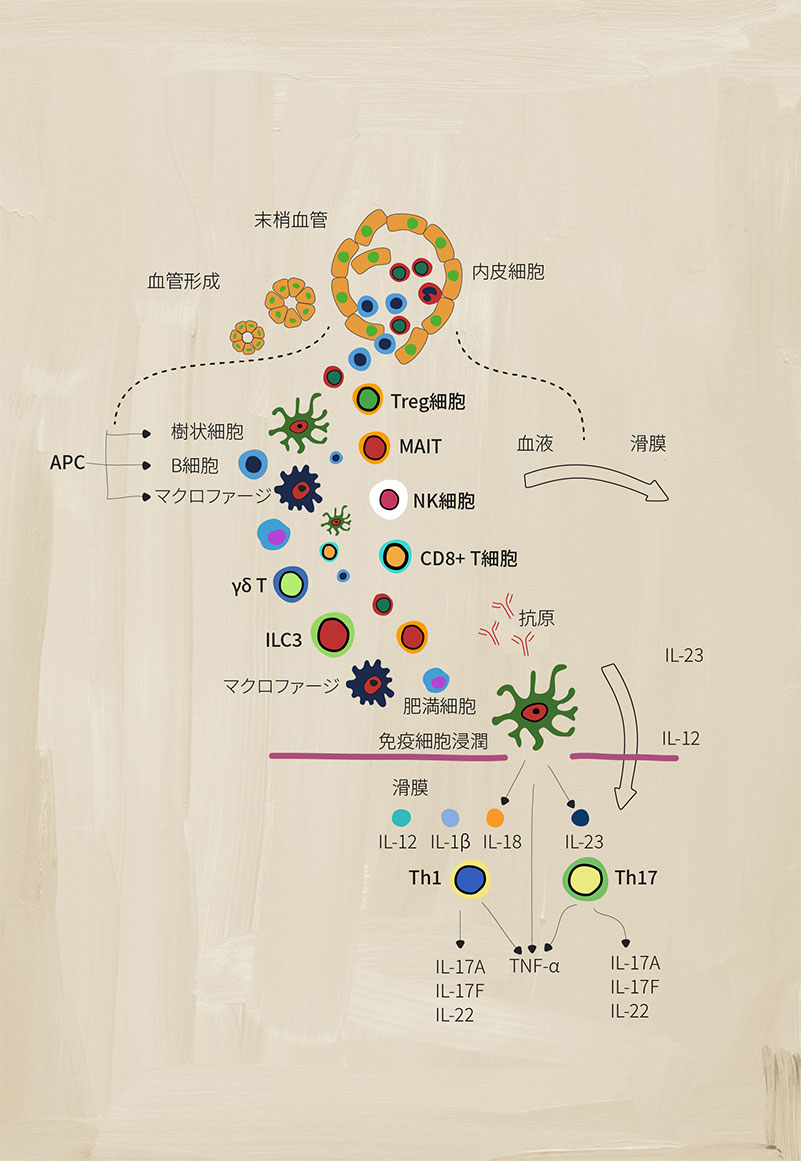
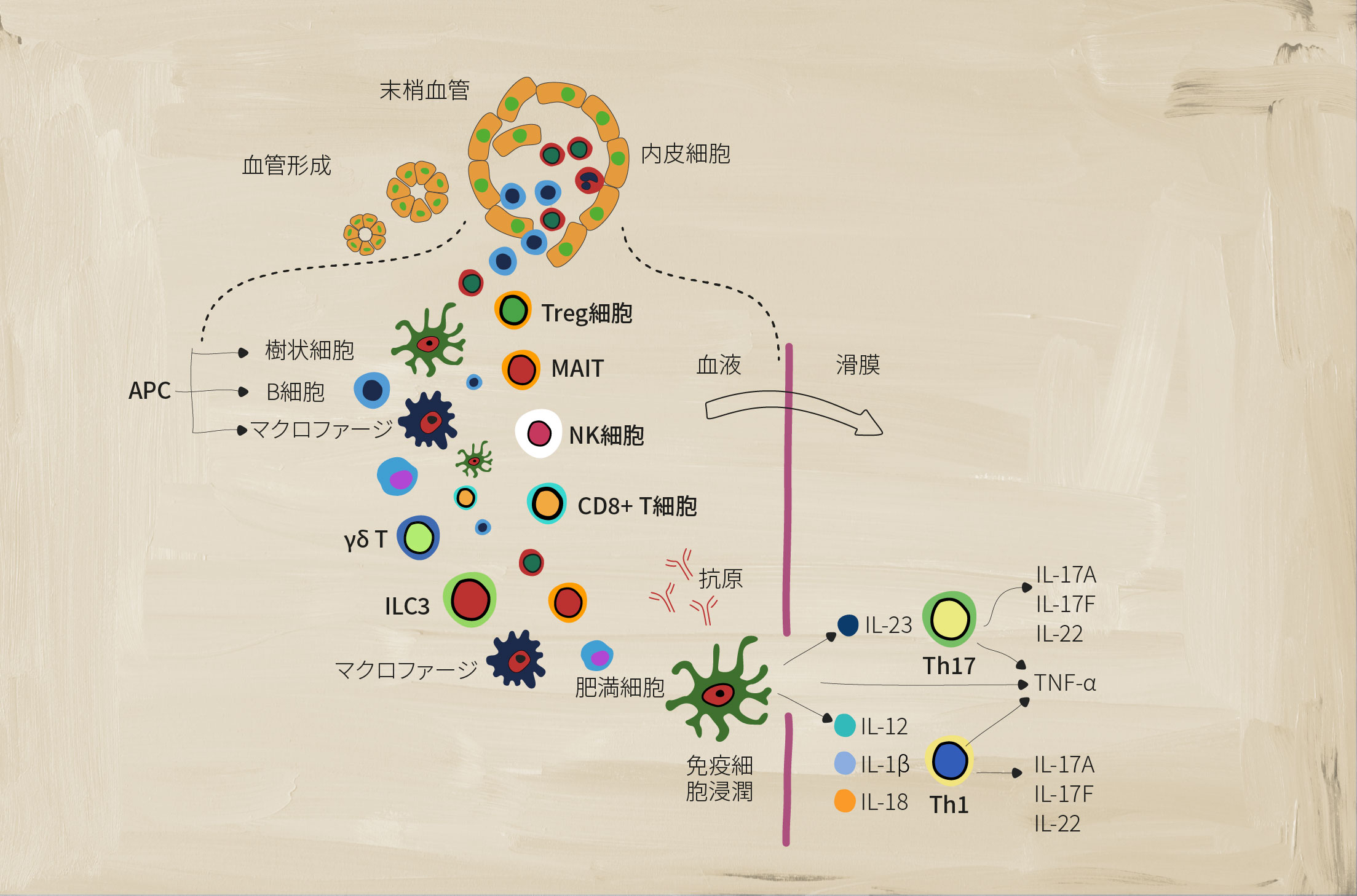
PsAにおけるさまざまな免疫細胞の役割
調節異常に陥った免疫系は、SpAの疾患症状の兆候である慢性炎症を引き起こす多くの要素を有している。獲得免疫細胞や自然免疫細胞は、炎症を媒介する重要な役割がある。1
- 自然免疫
- 獲得免疫
抗原提示細胞(APC)
どのようなものかAPCには、細胞性免疫に関与するB細胞、マクロファージ、樹状細胞(DC)が含まれる。これらは、T細胞など免疫系の他の要素によって認識されるように抗原を処理し、提示する。2
SpAにおける役割:
樹状細胞は、Th1およびTh2の炎症反応を刺激することで獲得免疫応答を活性化する一方で、単球由来のDCは、Th17細胞の炎症反応を引き起こすシグナル伝達経路の調節異常に関与している。3DCから分泌されるIL-23およびIL-12サイトカインは、T細胞のTh17およびTh1サブセットの分化を促進すると考えられている。1
マクロファージは、IL-12、IL-6、IL-23、TNF-αなどの多くの炎症誘発性サイトカインを大量に産生し、慢性炎症を持続させる。1例えば、活性化したマクロファージはIL-23を産生し、TH17細胞の分化を促進する。1これらの細胞は滑膜および付着部においてより多くの数が見られ、SpA疾患活動性と関連している。3
ガンマ・デルタT細胞 (γẟ T)
どのようなものか細胞表面に異なるT細胞受容体(TCR)γ鎖とδ鎖を持つT細胞のサブグループで、自然免疫のような様式で作用する。これらは、MHCに制限されない抗原認識と豊富なサイトカイン分泌で知られ、TCRの活性化がなくてもIL-17を産生するサブセットもある。5
SpAにおける役割:SpAでは、IL-23や抗CD3/CD28シグナルに反応してIL-17産生に大きく偏るIL-23+ γẟ T細胞が増加している。また、IL-17とGM-CSFを二重に産生するγẟ T細胞の増加が、SpA患者の末梢血で見られている。5
3型自然リンパ球細胞(ILC3)
どのようなものか自然免疫系におけるエフェクター細胞で、獲得免疫細胞によって通常発現される抗原受容体が再配列されていないもの。主に末梢組織に存在し、環境ストレスに応答し、組織のリモデリング、病原体に対する防御、恒常性の維持に関与する。4
SpAにおける役割:ILC3細胞はTh17細胞と似ており、IL-17、IL-22、GM-CSFを産生する。SpAでは、ILC3細胞数が増加し、IL-17を産生することによってIL-23とIL-1bに反応し、臨床症状・徴候の様々な部位(付着部など)で炎症誘発性状態をさらに促進させる。4
制御性T細胞
どのようなものか免疫反応を制御・抑制することができるT細胞の亜集団で、T細胞の活性化・増殖やサイトカインの産生を抑制することにより、自己免疫寛容を維持する上で重要な役割を果たす。7
SpAにおける役割:SpAにおけるTreg細胞の役割については、まだ議論が続いている。いくつかの研究では、AS患者の末梢血におけるTregの割合が低く、Tregの機能の低下が見られ、これはTregと正常な獲得免疫反応との間の不均衡を表している可能性がある。8
MR1拘束性T(MAIT)細胞
どのようなものか自然免疫と獲得免疫の両方にまたがる機能を持つユニークな「自然免疫に似た」T細胞。これらの細胞はエフェクターメモリー表現型を示し、細胞傷害反応や炎症誘発性反応を誘導する様々なサイトカイン/分子を産生する。6
SpAにおける役割:SpAでは、MAIT細胞は滑膜におけるIL-17、IFN-γおよびグランザイムB産生を誘導し、また循環中のMAIT細胞によるIL-17およびIL-22産生を増加させ、炎症誘発性状態を促進させる。1,6
ナチュラルキラー(NK)細胞
どのようなものか自然免疫系の重要な一部であり、酵素顆粒を使用して、事前に活性化することなく、細菌、ウイルス、および癌細胞を破壊する。NK細胞は、CD56の発現に基づいて3つの主要なグループ(dim(弱陽性)/bright(強陽性))に分けることができる。3
SpAにおける役割:SpAでは、CD56dim NK細胞の数が著しく増加することが知られている。HLA-B27を認識するNK細胞の表面受容体のバランスに変化が見られる。3通常では、NK細胞ではKIR3DL1受容体が多く、NK細胞傷害性機能の阻害につながる。SpAでは、KIR3DL1受容体は健常対照者よりも少なかった。3NK細胞はまた、TNF-αやIFN-γなどの炎症誘発性サイトカインを分泌することがあり、これらはSpAに関与することが示されている。1
CD8+ T細胞
どのようなものかCD8+t細胞は、獲得免疫系の重要な一部である。炎症誘発性サイトカインの産生、NK細胞のような細胞傷害性顆粒の産生、Fas/Fasリガンドシグナル伝達など、様々な機能を有する。3
SpAにおける役割:SpAでは、CD8+ T細胞はTNF-α、IFN-γ、IL-17などの炎症誘発性サイトカインを産生し、慢性炎症状態を増強する。3CD8+T細胞はまた、パーフォリン/グランザイム(細胞傷害性顆粒)の分泌とFas/Fasリガンドシグナル伝達によって細胞を溶解する。3
17型ヘルパーT(Th17)細胞
どのようなものかIL-6、IL-26、 IFN-γなどの他の炎症誘発性サイトカインを産生できる炎症誘発性サイトカインIL-17の産生によって特徴づけられるCD4+ T細胞のサブセット。3
SpAにおける役割:SpAでは、IL-23レベルの上昇がTh17細胞の産生を誘導する。3Th17細胞の数が多いと、IL-17が過剰に産生され、IL-22やTNF-αのような他の炎症性サイトカインの産生を含む炎症誘発性状態をさらに促進させる。1,3IL-17のレベルが上昇すると、線維芽細胞、内皮細胞、樹状細胞、マクロファージなど、さまざまな種類の細胞から、他の炎症誘発性メディエータの産生も誘導される。3
1型ヘルパーT(Th1)細胞
どのようなものかCD4+T細胞のサブセットで、ウイルス性および細菌性の病原体の識別と破壊に重要な役割を果たす。3これらの細胞は、インターフェロンガンマ(IFN-γ)、IL-2、TNF-α などの炎症誘発性サイトカインを分泌して、他の標的免疫細胞を活性化し、免疫応答を開始する。3
SpAにおける役割:SpAにおけるこれらの細胞の役割は、まだ議論されている。ある研究によると、Th1細胞の数と炎症誘発性IFN-γの産生に差異が見られず、他の研究では、IFN-γを産生するCD4+T細胞の増加と患者の血清中のIFN-γとTNF-αの増加が見られた。3
SpA=脊椎関節炎;APC=抗原提示細胞;DC=樹状細胞;TNF=腫瘍壊死因子;GM-CSF=顆粒球マクロファージコロニー刺激因子;MHC=主要組織適合性複合体;TCR=T細胞受容体;HLA=ヒト白血球抗原;IFN=インターフェロン;Treg=制御性T細胞;AS=強直性脊椎炎。
PsAにおけるサイトカイン調節異常
付着部の損傷後、局所細胞は炎症性メディエータとして化学誘引物質を産生する。これにより、局所免疫細胞や自然リンパ球がサイトカインを分泌する。これらは循環に入り、炎症組織にT細胞や自然免疫細胞をリクルートし、付着部で炎症誘発性サイトカインや制御性サイトカインを産生する。バランスの取れた状態では、その結果、修復メカニズムが制御され、効果的なものとなる。しかし、PsAでは、このプロセスのバランスが崩れ、サイトカインの調節異常が起こる。1,9-11
サイトカイン調節異常は、炎症性サイトカインの過剰および/または制御性サイトカインの枯渇によって特徴づけられ、病的骨形成を引き起こす可能性がある。サイトカインバランスは、遺伝的要因、マイクロバイオーム、環境要因の影響を受けるが、その多くはまだ解明されていない9,10

遺伝的危険因子
HLA対立遺伝子と遺伝率に関する研究では、乾癬よりもPsAの方が遺伝的要素が強いことが示唆されている。1例えば、HLA-B27と付着部炎、指趾炎、対称性仙腸関節炎との間には正の関連があり、HLA-B08とHLA-C07は関節癒合、非対称性仙腸関節炎、指趾炎と関連している。1
マイクロバイオームの影響
PsA患者では腸内マイクロバイオームに変化が認められる。特定の腸内細菌叢の存在は、分泌性IgAの高レベル化やRANKLの低濃度化など、炎症性サイトカインの変化と相関することが示されている。12
HLA=ヒト白血球抗原;IgA=免疫グロブリンA;RANKL=核因子κ-B受容体活性化因子リガンド
炎症部位
異なるサイトカインは異なる部位に関連し、異なる組織で異なる役割を担っている。13
-

関節
TNF、IL-17、IL-23p19、IL-12/23p40
-

体軸骨格
IL-17、TNF
-

付着部
IL-17, IL-12/23p40, TNF, IL-23p19
-
皮膚
IL-17, IL-23p19, IL-12/23p40, TNF
-

腸管
IL-12/23p40, TNF, IL-23p19
© Siebert S, Millar NL, McInnes IBから転載。Why did IL-23p19 inhibition fail in AS: a tale of tissues, trials or translation?. Ann Rheum Dis。2019;78(8):1015-1018 BMJ Publishing Group Ltd.から許可を得て掲載。

炎症につながる調節異常の可能性がある主要なサイトカインについて詳しく知る


病理生物学に関する次の展示室
骨障害
PsA患者の骨障害を引き起こす複雑な病態について掘り下げる
前の部屋
サイトカインの概要と役割
axSpAおよびPsAに関する詳しい情報については、UCBCares® Rheumatologyに登録してください
- Veale DJ, Fearon U. The pathogenesis of psoriatic arthritis. Lancet. 2018;391(10136):2273-2284. doi:10.1016/S0140-6736(18)30830-4
- Kambayashi T, Laufer TM. Atypical MHC class II-expressing antigen-presenting cells: can anything replace a dendritic cell?. Nat Rev Immunol. 2014;14(11):719-730. doi:10.1038/nri3754
- Rezaiemanesh A, Abdolmaleki M, Abdolmohammadi K, et al. Immune cells involved in the pathogenesis of ankylosing spondylitis. Biomed Pharmacother. 2018;100:198-204. doi:10.1016/j.biopha.2018.01.108
- Fang W, Zhang Y, Chen Z. Innate lymphoid cells in inflammatory arthritis. Arthritis Res Ther. 2020;22(1):25. Published 2020 Feb 12. doi:10.1186/s13075-020-2115-4
- Bank I. The role of gamma delta T cells in autoimmune rheumatic diseases. Cells. 2020;9(2):462. Published 2020. doi:10.3390/cells9020462
- Toubal A, Nel I, Lotersztajn S, et al. Mucosal-associated invariant T cells and disease. Nat Rev Immunol. 2019;19(10):643-657. doi:10.1038/s41577-019-0191-y
- Shevyrev D, Tereshchenko V. Treg heterogeneity, function, and homeostasis. Front Immunol. 2020;10:3100. Published 2020. doi:10.3389/fimmu.2019.03100
- Lai NL, Zhang SX, Wang J, et al. The proportion of regulatory T cells in patients with ankylosing spondylitis: a meta-analysis. J Immunol Res. 2019;2019:1058738. Published 2019. doi:10.1155/2019/1058738
- Watad A, Rowe H, Russell T, et al. Normal human enthesis harbours conventional CD4+ and CD8+ T cells with regulatory features and inducible IL-17A and TNF expression. Ann Rheum Dis. 2020;79(8):1044-1054. doi:10.1136/annrheumdis-2020-217309
- Watad A, Bridgewood C, Russell T, et al. The early phases of ankylosing spondylitis: emerging insights from clinical and basic science. Front Immunol. 2018;9:2668. Published 2018. doi:10.3389/fimmu.2018.02668
- McGonagle DG, McInnes IB, Kirkham BW, et al. The role of IL-17A in axial spondyloarthritis and psoriatic arthritis: recent advances and controversies [公開された修正がAnn Rheum Dis. 2020;79(1):e12に掲載]. Ann Rheum Dis. 2019;78(9):1167-1178. doi:10.1136/annrheumdis-2019-215356
- Clemente JC, Manasson J, Scher JU. The role of the gut microbiome in systemic inflammatory disease. BMJ. 2018;360:j5145. Published 2018. doi:10.1136/bmj.j5145
- Siebert S, Millar NL, McInnes IB. Why did IL-23p19 inhibition fail in AS: a tale of tissues, trials or translation?. Ann Rheum Dis. 2019;78(8):1015-1018. doi:10.1136/annrheumdis-2018-213654